Allgemeines zur rheumatoiden Arthritis
Die extraartikulären Manifestationen der RA nehmen in den letzten Jahrzehnten – nicht zuletzt aufgrund der besseren Therapiemöglichkeiten – kontinuierlich an Häufigkeit ab. Darauf wies erneut eine Untersuchung aus der RA-Langzeitkohorte der Mayo-Klinik hin. Im Vergleich der Zeiträume 1985-1999 und 2000-2014 reduzierte sich die Gesamthäufigkeit von 45 auf
31 %, auch alle Einzelmanifestationen bis auf Keratokonjunktivitis und sekundäres Sjögren-Syndrom zeigten eine Verringerung auf die Hälfte. (1)
Lifestyle-Faktoren wie Rauchen und Adipositas sind bekanntlich in der Lage, den Erfolg unserer therapeutischen Bemühungen zumindest teilweise zunichtezumachen. In San Diego lieferten zwei Beiträge zur Adipositas neue Belege: In einer Untersuchung aus der US-amerikanischen CATCH-Kohorte zeigte sich mit steigendem BMI eine zunehmende Häufigkeit und Intensität von Flares. So lag die Rate bei Vergleich eines BMI >30 vs. ≥25 sechsfach höher. (2) In einer Subanalyse bei 393 schwedischen Patienten aus der NORD STAR-Studie boten bei gleicher DMARD-Therapie Patienten mit einem BMI ≥30 vs. <30 einen deutlich schlechteren Outcome (z. B. DAS28-CRP 2,6 vs. 2,1, CDAI 7,5 vs. 5,0, signifikant niedrigere Rate an Remission und niedriger Krankheitsaktivität, LDA). (3) Auch wenn es schwierig ist, sollte der Rheumatologe Raucher und adipöse Patienten immer wieder auf die gravierenden Folgen dieser Lifestyle-Faktoren für den Langzeit-Outcome der RA (neben den zahlreichen anderen gesundheitlichen Nachteilen) hinweisen. Rezeptierbare Apps können möglicherweise bei der Bekämpfung helfen.
Eine große bevölkerungsbasierte US-amerikanische Kohortenstudie wies auf das gleichbleibend hohe Herzinsuffizienz-Risiko für RA-Patienten hin. Die Rate lag für RA bei 10,9/1.000 Patientenjahre, für die gematchten Kontrollen bei 7,9. Rätselhafterweise zeigte die Längsschnittuntersuchung, dass sich für die Herzinsuffizienz in den letzten 20 Jahren trotz der effektiveren Therapie kein Trend zur Besserung gezeigt hat. (4) Risikofaktoren für thromboembolische Ereignisse bei RA-Patienten wurden in einer französischen Studie ermittelt. Bei 405 RA-Patienten dieser Kohorte kam es 2021 zu 15 venös-thrombotischen Ereignissen und Lungenembolien (die geringe Rate an Ereignissen schmälert etwas die Aussagekraft). Als wichtigste assoziierte Faktoren erwiesen sich die Anamnese früherer Ereignisse, Hospitalisierung in den letzten drei und chirurgische Eingriffe in den letzten sechs Monaten, auch Januskinase-Inhibitoren (JAKi) wurden (allerdings bei minimaler Fallzahl) häufiger eingenommen. (5)
Ossäre Risiken durch Langzeiteinnahme von Protonenpumpenhemmern (PPI) wurden in zwei Studien ermittelt. In einer Berliner Analyse zeigte sich die Knochendichte bei Patienten unter gleichzeitiger Einnahme von Glukokortikoiden (GK) im Vergleich mit bzw. ohne PPI am Femur mit -1,24 vs. -1,0 und an der Lendenwirbelsäule mit -0,87 vs. -0,64 signifikant niedriger. Interessanterweise zeigte sich die knöcherne Mikroarchitektur durch PPI nicht verändert. (6) In einer amerikanischen Studie war bei RA-Patienten unter PPI eine signifikant erhöhte Rate an Knie- und Hüft-TEPs mit einer Odds Ratio (OR) von 1,31 zu ermitteln. (7)
Statine scheinen sich aufgrund vielfältiger Mechanismen protektiv auf das kardiovaskuläre Risiko bei RA-Patienten auszuwirken. Neben der lipidsenken, eher mäßig ausgeprägten antiinflammatorischen Wirkung kommt möglicherweise ein direkter Statin-spezifischer Effekt auf die arteriosklerotischen Plaques hinzu. Hierfür spricht eine Untersuchung aus dem ATACC-RA-Konsortium mit 4.357 Patienten. Hier war nur bei Statin-Nichtanwendern ein höheres CRP mit mehr Ereignissen verbunden, während dieser Effekt bei Statin-Einnahme nicht zu beobachten war. (8)
Aktuelle Erkenntnisse aus Strategiestudien
Womit niemand mehr rechnete: Auch 20 Jahre nach Beginn der BeST-Studie wurden nochmals Daten zum Langzeitverlauf vorgestellt! Kombiniert war das mit immerhin einen Zeitraum von 12 Jahren umfassenden Daten aus der IMPROVED-Studie, einer weiteren maßstabgebenden niederländischen Strategiestudie. Immerhin 45 bzw. 54 % der noch lebenden Patienten konnten erfasst werden, die Ergebnisse waren – bedenkt man den langen Zeitraum – sensationell. 91 % der Patienten waren weiter in Remission oder einer LDA, der HAQ lag im Median bei 0,75 bzw. 0,50 und damit unverändert niedriger als zu Beginn dieser Studien. Die mediane radiologische Progression war weiter minimal. (9)
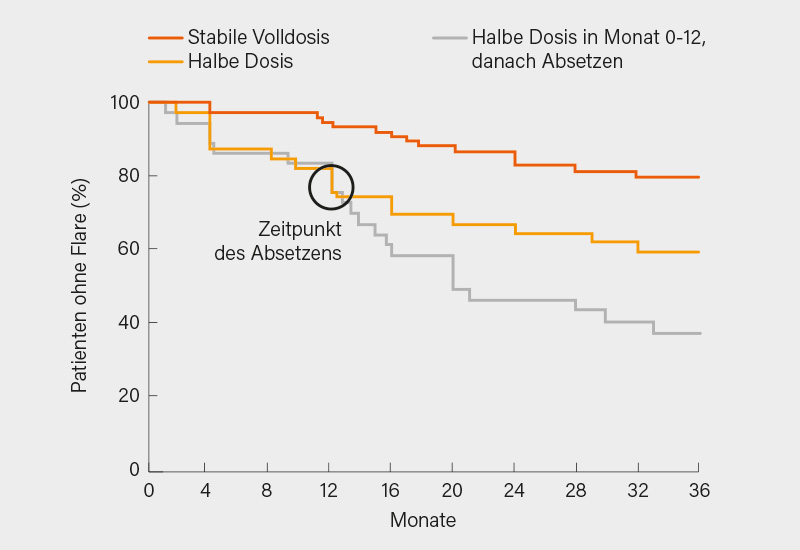
ARCTIC REWIND ist eine norwegische Tapering-Studie, von der in San Diego 3-Jahres-Daten vorgestellt wurden. Der erste Teil untersuchte das Tapering von csDMARDs. Bei einem Flare wurde wieder auf die Volldosis gewechselt. Der Anteil der Patienten ohne Flare lag bei kontinuierlich durchgeführter Volldosis-Therapie über drei Jahre bei 80 %, bei Dosishalbierung nach 12 Monaten im Dreijahreswert bei 60 % und bei komplettem Absetzen zum gleichen Zeitpunkt bei 38 % (Abb. 1). Die Remissionsrate lag in den drei Gruppen immerhin bei 96, 94 und 91 %, eine radiologische Progression war nur minimal feststellbar (0,5 Punkte). Da die meisten Patienten bei Flare und erneuter Volldosis wieder sehr gut ansprachen, kann dieser Teil der Studie als Plädoyer für Tapering-Versuche verstanden werden. (10)
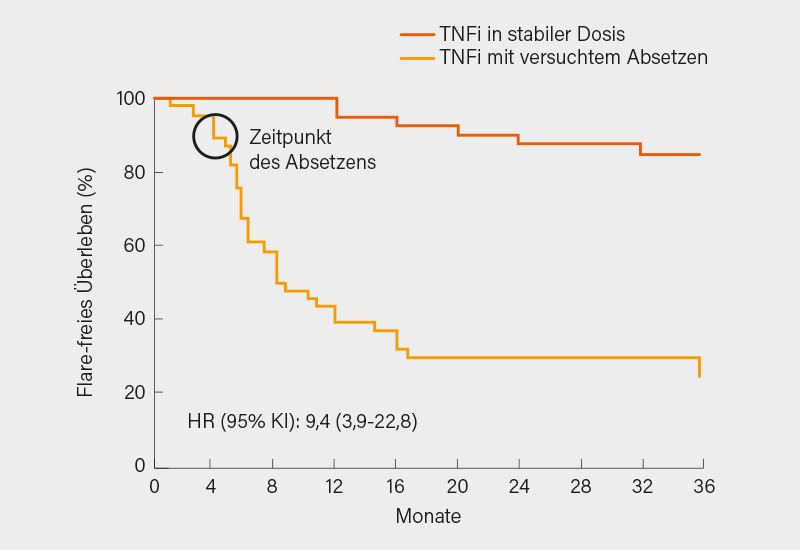
Nicht ganz so erfolgreich war der zweite Teil, der mit TNFα-Inhibitoren (TNFi) durchgeführt wurde. Hier wurden allerdings merkwürdigerweise nur Fortsetzung und Absetzen verglichen, eine Dosishalbierung (die eher unserem Vorgehen in der Praxis entsprochen hätte) fehlte. Nach drei Jahren waren 85 vs. 25 % ohne Flare, was zum einen belegt, dass ein komplettes Absetzen der TNFi nur selten gelingt (Abb. 2). Da jedoch auch hier die erneute Therapie in 81 % wieder zur Remission führte, war letztlich ein Schaden für die Patienten nur in Einzelfällen anzunehmen, umgekehrt konnten einige Therapiekosten eingespart werden. Die negative Interpretation der Daten durch die Autoren war so eigentlich nicht nachvollziehbar. (11)
Konventionelle DMARDs und Biologika im Fokus
Einen neuen Risikoscore stellte eine Bostoner Arbeitsgruppe zur Retinopathie unter Hydroxychloroquin (HCQ) vor. In einer Kohortenstudie mit 4.151 Patienten unter mindestens fünfjähriger HCQ-Therapie stellten sich als relevante Faktoren für die Score-Berechnung neben Geschlecht, Alter und Körpergewicht vor allem die GFR, die kumulative Dosis in fünf Jahren und eine gegenwärtige Dosis von >5 mg/kg/Tag heraus. (12)
Zu Methotrexat (MTX) wurde ein systematischer Review mit der Frage einer Assoziation mit gehäuftem Auftreten von Lymphomen präsentiert, acht Studien wurden ausgewertet. Nur zwei japanische Studien zeigten eine (sehr geringe) Assoziation, sämtliche in anderen Populationen durchgeführten Studien hingegen nicht. (13) Eine spannende kontrollierte indische Studie konnte zeigen, dass oral verabreichtes MTX bei Splitting einer 25 mg-Wochendosis mit einer Wirksteigerung verbunden ist: Im Vergleich zu 25 mg in Einmaldosis sorgte eine Aufteilung in 10 mg morgens und 15 mg abends nahezu für eine Verdopplung der Ansprechrate. (14)
Schwere Infektionen (SIE) unter TNFi-Therapie werden immer seltener. In einer Studie aus dem isländischen Register mit 1.387 TNFi-behandelten Patienten und gematchten Kontrollen wurden vier Perioden (2003-2006, 2007-2010, 2011-2014 und 2015-2018) miteinander verglichen. Die Häufigkeit von SIE nahm kontinuierlich ab, die Inzidenzraten-Ratio (IRR) sank bei Vergleich der letzten mit der ersten Periode auf 0,46. (15) Ein sorgfältigerer Umgang mit Hochrisikopatienten und der Einsatz von TNFi bei weniger schwer erkrankten RA-Patienten in jüngerer Zeit könnten die Hauptgründe sein.
Die Wirksamkeit von Rituximab ist im Langzeitverlauf vom Grad der B-Zell-Depletion unabhängig: Das ist das wichtige Ergebnis einer retrospektiven Kohortenstudie mit 126 RA-Patienten. (16) Offenbar macht es somit wenig Sinn, den Grad der B-Zell-Depletion während der Therapie zu überprüfen und womöglich daraufhin die Therapie zu intensivieren.
Bisher ist aufgrund widersprüchlicher Daten nicht klar, ob TNFi bei Vorliegen einer RA-assoziierten interstitiellen Lungenerkrankung (ILD) nützlich oder sogar schädlich sind. In einer Vergleichsstudie mit je 237 gematchten Patienten wurden jetzt TNFi- mit Nicht-TNF-bDMARDs und tsDMARDs bezüglich des pulmonalen Outcome verglichen. Es zeigten sich im Wesentlichen keine Unterschiede, sodass nach dieser Studie TNFi offenbar doch keine negativen Auswirkungen haben. (17)
Update zu den JAK-Inhibitoren
In der Investigator-initiierten PERFECT-RA-Studie erwies sich Baricitinib im Head-to-head (H2H)-Vergleich mit TNFi als überlegen. Nach 12 Wochen lag die Remissionsrate bei 74 vs. 47 %, aber auch nach 48 Wochen war der JAKi noch in allen sekundären Endpunkten signifikant überlegen – ein weiterer Beleg dafür, dass JAKi bei RA gegenwärtig das wohl bestwirksame Therapieprinzip darstellen. (18) Dies konnte auf den ersten Blick in einer Analyse aus dem US-amerikanischen CorEvitas-Registers mit Vergleich des Outcome unter Etanercept, Adalimumab und JAKi nicht bestätigt werden, die Ergebnisse zeigten keine Unterschiede. Allerdings wurde nicht klargelegt, ob Unterschiede in den Krankheitsmerkmalen (z. B. Krankheitsdauer, Zahl der Vortherapien) bestanden. (19)
In einer Post-hoc-Analyse der SELECT-COMPARE-Studie wurde die schmerzlindernde Wirkung von Upadacitinib und Adalimumab miteinander verglichen. Es wurden zwei Arten von Schmerzwirkung unterschieden, direkt (ermittelt durch TJC und Schmerz) und indirekt via Entzündungshemmung (ermittelt durch SJC, BSG und CRP). Es stellte sich heraus, dass die schmerzlindernde Wirkung durch Entzündungshemmung bei beiden Substanzen gleich gut gelang, während sich Upadacitinib bezüglich der entzündungsunabhängigen direkten Schmerzwirkung als überlegen erwies, möglicherweise ein Hinweis auf einen zusätzlichen (zentralnervösen?) Schmerzeffekt der JAKi. (20)
In einer großen bevölkerungsbasierten Kohortenstudie mit 12.612 RA-Patienten wurde die Fünf-Jahres-Mortalität unter verschiedenen DMARD verglichen. Auch hier schnitten JAKi am besten ab, sie boten leichte Vorteile gegenüber TNFi und Interleukin-6-Rezeptorinhibitoren (IL-6Ri) und deutlich bessere Raten im Vergleich zu Abatacept und Rituximab. (21) Wie schon zuvor beim EULAR-Kongress und in der Literatur der letzten 12 Monate fanden sich auch in San Diego keine die ORAL Surveillance-Studie bestätigenden Ergebnisse bezüglich eines erhöhten Risikos der JAKi für kardiovaskuläre und thromboembolische Ereignisse. In zwei auf Versicherungsdaten fußenden Fall-Kontroll-Studien wurden bei Patienten mit axialer Spondyloarthritis und Psoriasis-Arthritis schwere kardiale Ereignisse und thromboembolische Ereignisse unter bDMARDs und JAKi verglichen. Es fanden sich bezüglich beider Ereignisse keine signifikanten Unterschiede. (22)
Eine placebokontrollierte indische Studie legt nach Untersuchung von 81 konsekutiven herzgesunden Patienten mit neu begonnener Tofacitinib-Therapie sogar einen kardioprotektiven Effekt der Substanz nahe. Neben der klinischen Besserung führte die Therapie über 12 Wochen auch zu einer signifikanten Verbesserung der endothelialen Dysfunktion. (23) Auch bei RA-ILD scheinen JAKi nach nunmehr schon mehreren publizierten Studien zu den DMARD zu zählen, die einen positiven Effekt ausüben. In San Diego wurde eine spanische Multicenter-Studie mit 73 Patienten unter Therapie mit verschiedenen JAKi (am häufigsten Baricitinib) vorgestellt, die nach im Mittel 36 Monaten einen stabilen Verlauf von Vitalkapazität (FVC) und Diffusionskapazität (DLCO) zeigten, im HRCT boten 76 % eine Stabilisierung oder sogar Besserung. (24)
In einer Auswertung aus dem RABBIT-Register wurde die Häufigkeit von Malignomen unter den einzelnen DMARD-Gruppen im Zeitraum 2017-2022 miteinander verglichen – mit einem überraschenden Ergebnis. Während sich zunächst (und auch im Abstract festgehalten) sowohl bei Auswertung aller Patienten als auch bei separater Auswertung einer Risikopopulation (ORAL Surveillance-ähnlich) keine signifikanten Unterschiede zwischen JAKi, TNFi, anderen bDMARDs und csDMARDs ergaben, führte eine Regressionsanalyse dazu, dass die Hazard Ratio (HR) für JAKi im Vergleich zu TNFi signifikant höher lag, insbesondere in der Hochrisikopopulation. Allerdings wiesen JAKi- im Vergleich zu TNFi-Patienten ein höheres Alter, längere Krankheitsdauer, mehr Komorbiditäten und mehr frühere DMARD-Therapien auf, stellten also insgesamt bezogen auf Risiken eine negative Selektion dar. Weitere Analysen werden zeigen müssen, ob diese Begründung ausreicht. (25)
Verschiedenes aus San Diego
Eine auf den ersten Blick seltsam anmutende Untersuchung versuchte einen Bezug zwischen der Adhärenz bei RA-Patienten und jahreszeitlichen Einflüssen herzustellen. Überraschend wurde tatsächlich ein (nicht so recht erklärlicher) Einfluss gefunden: In den Wintermonaten ließ die Adhärenz vor allem unter TNFi, aber nicht unter JAKi-Therapie signifikant nach. Ein etwas geringerer ähnlicher Einfluss wurde für IL-6Ri und Abatacept gezeigt – aber nur in Gegenden mit nasskaltem winterlichem Klima. (26) Einen negativen Einfluss auf das Risiko unerwünschter Ereignisse bei Einnahme von SGLT2-Inhibitoren offenbarte eine Untersuchung der Harvard-Universität. Verglichen wurden je 519 Patienten mit entzündlich-rheumatischen Erkrankungen (ERE) und gematchte Kontrollen. Zahlreiche unerwünschte Wirkungen, darunter vor allem Infektionen und muskuläre Probleme, traten bei ERE-Patienten signifikant häufiger auf, die HR lag bei 1,74. Frauen waren signifikant häufiger betroffen. (27)
Verschiedene offene Untersuchungen haben in der Vergangenheit eine gute Wirkung von Vagusnerv-Stimulation (VNS) bei RA-Patienten nahegelegt. Jetzt hat eine randomisierte, Sham-kontrollierte Studie all diese Ergebnisse widerlegt. Die VNS wurde zwar gut vertragen, erwies sich aber leider nicht besser wirksam im Vergleich zur Sham-Gruppe. (28) Hingegen führte die Lifestyle-orientierte holländische „Plants for Joints"-Studie zunächst in der 16-wöchigen kontrollierten Phase zu guten Resultaten, jetzt wurden die ebenfalls erfolgreichen Langzeitdaten über 20 Monate vorgestellt. Eine Kombination von „Whole-food plant-based"-Diät, körperlicher Aktivität und Stressmanagement wurde mit einer Standard-of-Care-Versorgung über 16 Wochen kontrolliert verglichen und bot zunächst eine signifikante Besserung aller Aktivitätsparameter (z. B. DAS28 von 3,85 auf 3,09), aber auch positive Auswirkungen auf den Stoffwechsel (u. a. Gewichtsabnahme von 74,5 auf 71,5 kg). Die klinische Besserung hielt anschließend über ein Jahr an, die Stoffwechseleffekte hingegen verpufften, was wohl auf Adhärenzprobleme zurückzuführen war. (29)
Prof. Dr. med. Klaus Krüger
Facharzt für Innere Medizin und Rheumatologie
Praxiszentrum St. Bonifatius
St.-Bonifatius-Str. 5, 81541 München
Literatur: 1 Kimbrough B et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1296 | 2 Butler M et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0397 | 3 Maglio C et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0406 | 4 Johnson T et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0743 | 5 Oudart F et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1298 | 6 Palmowski A et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 2531 | 7 Sangaraju K et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0321 | 8 Karpouzas G et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1306 | 9 Heckert S et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1273 | 10 Kjørholt KK et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 2543 | 11 Lillegraven S et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. L07 | 12 Jorge A et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 2453 | 13 Alexander SA et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0438 | 14 Dhir V et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1583 | 15 Bjornsson AH et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0981 | 16 Ghossan R et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0732 | 17 England B et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1582 | 18 Van de Laar M et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0450 | 19 Pappas D et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0441 | 20 Taylor PC et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0429 | 21 Chen H-H. Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0984 | 22 Merjanah S et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0739 | 23 Syngle A et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0448 | 24 Serrano-Combarro A et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 2174 | 25 Schaefer M et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1632 | 26 Delgado S et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1847 | 27 Oakes EG et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0741 | 28 Baker M et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 0837 | 29 Wagenaar C et al., Arthritis Rheumatol 2023; 75 (Suppl 9): Abstr. 1331