Die präklinische Phase der RA ist durch das Vorliegen von ACPA, subklinischer Arthritis und Schmerzen gekennzeichnet. ACPA-positive Personen mit entzündlichen oder strukturellen Läsionen in der Bildgebung, haben ein hohes Risiko für den Übergang zur manifesten RA. Ob bereits zu diesem Zeitpunkt interveniert werden soll, ist strittig. Da die T-Zell-vermittelte B-Zell-Aktivierung ein wichtiger Trigger für die Entwicklung einer RA ist, wäre Abatacept eine interessante frühe Therapieoption zum Aufhalten dieses Prozesses, da es die Aktivierung von T-Zellen unterbricht und recht gut verträglich ist.
Die Beantwortung der Frage, ob und bei wem bei „präklinischer RA“ eine frühe medikamentöse Intervention gerechtfertigt wäre, ist schwierig. Erste Anhaltspunkte dafür, dass dies prinzipiell möglich wäre, hatte die PRAIRI-Studie mit Rituximab geliefert, die TREAT-EARLIER-Studie mit Methotrexat, dessen Einsatz in solch einem RA-Risikokollektiv naheliegender wäre, hatte aber eher gemischte Ergebnisse generiert. Bessere Daten mit Abatacept bot die deutsche ARIAA-Studie, die bei ACPA-positiven „at-risk“-Personen zumindest auf eine gewisse Verzögerung der Progression zur RA hinwies, in die gleiche Richtung weist auch die britisch-niederländische APPIPRA-Studie.
APIPPRA: Teilerfolg für Frühintervention mit Abatacept
Zunächst zu der von Andrew P. Cope, London (Großbritannien), und Kollegen vorgestellten randomisierten, doppelblinden, placebokontrollierten Phase-IIb-Studie APIPPRA.
In die Studie wurden an „Früharthritis-Kliniken“ mit Krankenausanbindung 213 ACPA+/RF+- oder ACPAhi (≥3 x ULN)/RF+-Individuen mit Arthralgie (keine frühere klinische Synovitis, keine vorherigen Steroide oder DMARDs) eingeschlossen und stratifiziert nach Geschlecht, Raucherstatus und Land (28 Einrichtungen in Großbritannien und 3 in den Niederlanden) für 52 Wochen im Verhältnis 1:1 auf 1x/Woche s.c. Abatacept 125 mg (n=110) oder Placebo (n=103) randomisiert. Die Teilnehmer waren im Mittel 49 Jahre alt, 77 % waren Frauen (93 % hohe ACPA-Titer [ACPAhi], max. moderate subklinische Synovitis, 73 % mit Power-Doppler-Score =0). Nach Beendigung der Therapie schloss sich ein Follow-up über weitere 52 Wochen an. Primärer Endpunkt war die Entwicklung einer klinischen Synovitis in ≥3 Gelenken oder einer RA nach den ACR/EULAR-Klassifikationskriterien aus 2010.
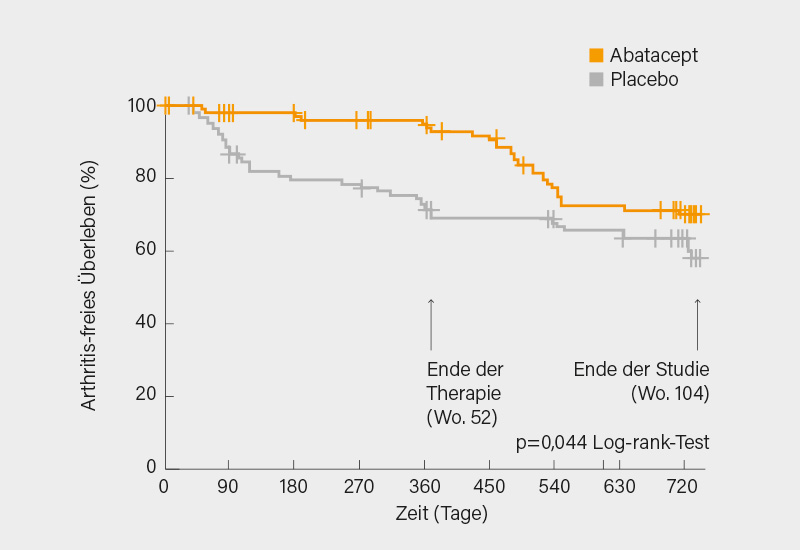
In der Intention-to-Treat (ITT)-Analyse kam es zu 65 primären Endpunkt-Ereignissen, in Woche 52 war dies bei 30 Teilnehmern (29 %) unter Placebo und 7 (6 %) unter Abatacept der Fall, nach 104 Wochen bei 38 (37 %) im Placebo- gegenüber 27 (25 %) im Abatacept-Arm. Der geschätzte Anteil von nach 12 Monaten Arthritis-freien Teilnehmern betrug 92,8 % in der Abatacept- und 69,2 % in der Placebo-Gruppe, nach 24 Monaten waren es 70,4 vs. 58,5 %. Kaplan-Meier-Plots zum Arthritis-freien Überleben über 24 Monate zeigten einen signifikanten Vorteil für Abatacept, auch wenn dieser im zweiten Jahr geringer wurde (Log-rank-Test p=0,044) (Abb. 1).
Interessant sind die Ergebnisse einer Post-hoc-Analyse im Hinblick auf den Autoantikörper-Status. Besonders trat der Nutzen von Abatacept bei den Patienten mit hohen ACPA-Titern hervor (ACPAhi: >340 IU/ml) sowie bei Patienten mit breitem Autoantikörperspektrum (IgG ACPA, IgA ACPA, ACarP, AAPA, IgM RF).
Die Differenz in der mittleren Überlebenszeit zwischen beiden Gruppen betrug – jeweils zugunsten von Abatacept – 53 Tage nach 12 Monaten (95% KI 28-78; p<0,0001) und 99 Tage (95% KI 38-161; p=0,0016) in Monat 24. Während der Therapie war Abatacept im Vergleich zu Placebo mit einer Verbesserung der Schmerz-Scores, des körperlichen Wohlbefindens und der Lebensqualität sowie niedrigen Synovitis-Scores im Ultraschall assoziiert, jedoch wurden diese Effekte nicht über 24 Monate aufrechterhalten.
Die Verträglichkeit war insgesamt gut (7 vs. 11 schwere unerwünschte Ereignisse [UE] unter Abatacept bzw. Placebo; je 1, nicht therapieassoziierter Todesfall in beiden Gruppen). Eine längere präventive Abatacept-Therapie wäre wohl vertretbar und hätte vermutlich noch bessere Effekte erzielt, dennoch dürfte diese Strategie noch nicht reif für die Praxis sein. (1)
ARIAA: Weitere Daten zu Abatacept bei präklinischer RA
Bereits vor Erstpräsentation der APPIPRA-Studie hatte die ähnliche, aber erst jetzt von Georg Schett, Erlangen, und Kollegen publizierte internationale, randomisierte, doppelblinde, placebokontrollierte ARIAA-Studie für Schlagzeilen gesorgt. In dieser war geprüft worden, ob Abatacept (hier aber nur über 6 Monate appliziert) bei Patienten mit subklinischer Arthritis und hohem RA-Risiko deren Manifestation verhütet oder zumindest verzögert.
In die Studie wurden an 14 Krankenhäusern bzw. Zentren (11 in Deutschland, 2 in Spanien und eines in Tschechien) ACPA-positive Patienten mit Arthralgie (Gelenkschmerzen ohne Schwellung), Entzündung im Hand-MRT (Zeichen von Osteitis, Synovitis oder Tenosynovitis) und somit hohem Risiko für RA eingeschlossen. Zwischen 2014 und 2019 wurden 100 Patienten für 6 Monate auf wöchentlich s.c. Abatacept s.c. 125 mg oder Placebo randomisiert (je n=50) mit einem folgenden doppelblinden 12-monatigen Follow-up ohne Therapie.
Primärer Endpunkt der Studie war der Anteil von Teilnehmern mit einer Verbesserung in mindestens einem der MRT-Entzündungsparameter nach 6 Monaten (jede Veränderung ab Baseline >0 bei Synovitis, Tenosynovitis und Osteitis) gemäß dem RAMRIS-Score (in der ITT-Population: n=98; n=49 in beiden Gruppen, 71 % Frauen, 29 % Männer).
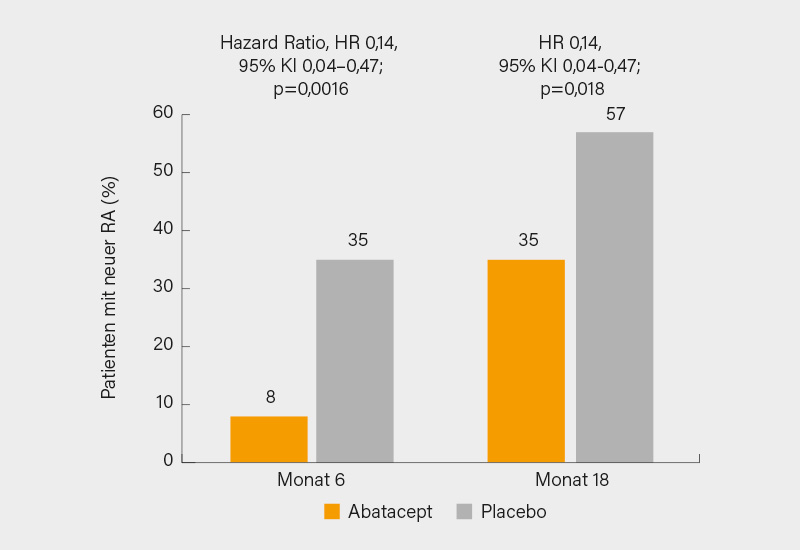
Der primäre Endpunkt wurde signifikant erreicht: Zu einer Verbesserung des subklinischen MRT-Entzündung kam es zu Monat 6 bei 28 (57 %) der Teilnehmer unter Abatacept und 15 (31 %) unter Placebo (absolute Differenz 26,5 %, 95% KI 5,9-45,6; p=0,014). Eine manifeste RA entwickelten lediglich 4 Teilnehmer (8 %) in der Abatacept- gegenüber 17 (35 %) in der Placebo-Gruppe (Hazard Ratio, HR 0,14, 95% KI 0,04–0,47; p=0,0016) (Abb. 2).
Nach 18 Monaten (also 12 Monate nach Beendigung der Therapie) wurde eine Verbesserung (mindestens einer) der MRT-Entzündungsparameter bei 25 Teilnehmern (51 %) unter Abatacept (bis Monat 6 gegeben) und 12 (24 %) unter Placebo verzeichnet (p=0,012), auch zu einer Progression zur RA kam es bis Monat 18 signifikant seltener in der Abatacept-Gruppe (bei 17 Teilnehmern, 35 %) im Vergleich zum Placebo-Arm, in dem dies bei 28 Probanden (57 %) der Fall war (HR 0,14, 95% KI 0,04-0,47; p=0,018) (Abb. 2b). Zu 12 schweren UE (aber zu keinen Todesfällen) kam es bei 11 Teilnehmern, 4 (8 %) im Abatacept- und 7 (14 %) im Placebo-Arm.
Somit verbesserte Abatacept auch noch 12 Monate nach dessen Absetzen signifikant die subklinische Arthritis bei Patienten mit hohem RA-Risiko, was die Hypothese stützt, dass eine frühe Intervention mit Abatacept der Entwicklung einer RA entgegenwirken oder diese wenigstens verzögern kann. (2) Dennoch bleibt zu konstatieren, dass auch im Placebo-Arm viele der Teilnehmer keine RA entwickelten, sodass eine Übertherapie nicht auszuschließen ist – die Diskussion wird also sicher weitergehen.
Fazit
Für die tägliche Praxis ist eine solche Frühintervention mit Abatacept trotz einer relativ guten Verträglichkeit sicherlich noch keine Option, denn selbst in Hochrisikopopulationen (Arthralgie, ACPA/RF-positiv) entwickeln mindestens 30 % dieser „at risk“-Personen auch nach zwei Jahren keine RA – das Argument einer potenziellen Übertherapie bei einer signifikanten Anzahl von „Patienten“ ist somit nicht von der Hand zu weisen. Am ehesten könnte Abatacept für „Patienten“ mit (sehr) hohen ACPA-Titern bzw. vielen ACPA-Serotypen eine Option sein. Zu bedenken ist dessen ungeachtet, dass eine frühe RA, vor allem bei zeitnaher Diagnosestellung, sehr gut behandelt werden kann, wie beispielsweise die hohen Remissionsraten etwa in der belgischen CareRA- oder skandinavischen NORD-STAR-Studie zeigen.
Quellen:
1 Lancet 2024; 403(10429): 838-849
2 Lancet 2024; 403(10429): 850-859