Ergebnis eines systematischen Literaturreviews waren nach der finalen Abstimmung sieben (statt zuvor sechs) „Overarching Principles“ und elf (statt zuvor zwölf) Empfehlungen, nur vier blieben unverändert, sieben sind neu oder wurden modifiziert. Nicht näher eingegangen sei auf die übergreifenden Prinzipien, da nur zwei der früheren sechs minimal in puncto Wording geändert wurden. Neu hinzugekommen ist (v. a. beeinflusst durch die Warnhinweise zu JAK-Inhibitoren) die Maßgabe, dass bei der Wahl der Therapie Sicherheitsaspekte bestimmter „mode of actions“ berücksichtigt werden sollten, um das Nutzen/Risiko-Profil zu optimieren.
Die neuen Empfehlungen im Überblick
Unverändert blieb Empfehlung 1), wonach die Therapie am Erreichen einer Remission oder alternativ niedrigen Krankheitsaktivität mit regelmäßiger Bestimmung der Krankheitsaktivität und Anpassung der Therapie ausgerichtet werden sollte („Treat-to-target“). Modifiziert wurde Empfehlung 2) mit einer relativen Abwertung von NSAR und Steroiden: NSAR können zur Linderung muskuloskelettaler Zeichen und Symptome eingesetzt werden, lokale Glukokortikoid (GK)-Injektionen (keine systemischen GK!) können als Zusatztherapie erwogen werden. Hintersinn: der frühere Einsatz von csDMARDs. Noch stärker erfolgt eine Ausrichtung auf den Phänotyp. Modifiziert wurde somit Empfehlung 3): Bei Patienten mit Polyarthritis oder Mono/Oligoarthritis mit negativen prognostischen Faktoren (z. B. strukturelle Schäden, erhöhtes CRP/ESR, Dakytlitis oder Nagelbeteiligung) soll rasch ein csDMARD initiiert werden, bei klinisch relevanter Hautbeteiligung wird dabei Methotrexat (MTX) präferiert.
Unverändert blieb Empfehlung 4), wonach bei unzureichendem Ansprechen auf ≥1 csDMARD ein bDMARD begonnen werden sollte. Aufgrund ähnlicher Ansprechraten in puncto Gelenke werden keine spezifischen bDMARDs präferiert (mit Verweis auf die H2H-Studien mit IL-17A-Inhibitoren vs. Adalimumab). Modifiziert wurde Empfehlung 5): Bei peripherer Arthritis und unzureichendem Ansprechen auf ≥1 bDMARD, oder wenn ein bDMARD unangemessen ist, kann nach Berücksichtigung von Sicherheitsaspekten ein JAK-Inhibitor erwogen werden. Unverändert blieben die Empfehlungen 6) und 7), wonach bei milder Erkrankung und unzureichendem Ansprechen auf ≥1 csDMARD, wenn weder ein bDMARD noch JAK-Inhibitor angemessen sind, ein PDE-4-Inhibitor (=Apremilast) erwogen werden kann. Bei eindeutiger Enthesitis und inadäquatem Ansprechen auf NSAR oder lokale GK-Injektionen kann ein bDMARD erwogen werden.
Modifiziert wurde Empfehlung 8): Bei Patienten mit klinisch relevanter axialer Erkrankung mit unzureichendem NSAR-Ansprechen kann eine Therapie mit einem IL-17A-, TNF-, IL-17A/F-Inhibitor oder JAK-Inhibitor (Vorsicht bei Patienten >65 Jahre, aktuellen/früheren Langzeitrauchern, mit Vorgeschichte von kardiovaskulären [CV] Erkrankungen oder anderen CV-Risikofaktoren [RF] oder anderen RF für Malignitäten sowie bekannten RF für venöse Thromboembolien) erwogen werden – hier orientierte man sich primär an der Zulassung bei axialer SpA und ließ die IL-23-Inhibition außen vor.
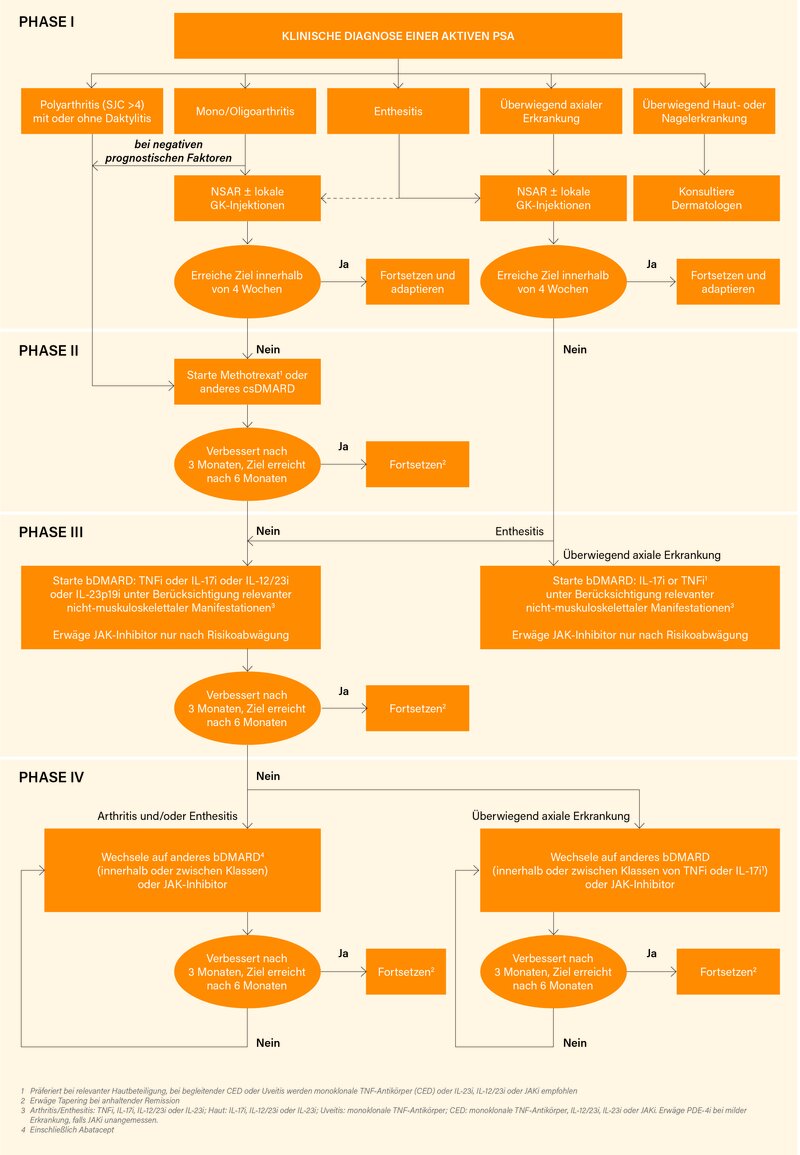
Neu ist Empfehlung 9): Die Wahl des Therapieprinzips sollte nicht-muskuloskelettale Manifestationen der PsA berücksichtigen. So sollte bei klinisch relevanter Hautbeteiligung ein IL-17A-, IL-17A/F-, IL-23- oder IL-12/23-Inhibitor präferiert werden, bei Uveitis ein monoklonaler Anti-TNF-Antikörper und bei chronisch-entzündlichen Darmerkrankungen (CED) ein monoklonaler Anti-TNF-Antikörper, IL-12/23-, IL-23- oder JAK-Inhibitor. Modifiziert wurde Empfehlung 10): Bei Patienten mit unzureichendem Ansprechen oder Unverträglichkeit eines bDMARD oder JAK-Inhibitors, sollte der Wechsel auf ein(en) anderes bDMARD oder JAK-Inhibitor erwogen werden, dies auch innerhalb derselben Substanzklasse. Gleich blieb Empfehlung 11), wonach bei anhaltender Remission ein Tapering von DMARDs erwogen werden kann. Ein weiteres Zugehen auf die GRAPPA-Empfehlungen ist unverkennbar, wie auch der 4-phasige Therapiealgorithmus mit Differenzierung nach verschiedenen Manifestationen zeigt (Abb.).
Quelle: Ann Rheum Dis 2024; doi: 10.1136/ard-2024-225531